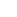2025年ESMO大會,再次成為全球腫瘤藥物研發創新的風向標。 在持續重構的研發版圖中,ADC與ADC+IO組合療法演變為炙手可熱的黃金賽道,中國Biotech也在這一浪潮中加速崛起,而樂普生物,正在引領這股科技風潮。
今年,樂普生物以三項研究入選ESMO,覆蓋EGFR ADC+PD-1聯合策略與TF新靶點ADC佈局,集中展現了從單靶到聯合、從單癌種到多領域的體系化創新能力。
樂普生物所構建的以ADC為覈心、免疫協同為驅動的治療矩陣,也成為其在腫瘤領域的核心競爭力所在。
突破耐藥困局:EGFR ADC+PD-1組合在鼻咽癌的長期療效驗證
樂普生物的研發佈局,始終立足於中國患者最迫切的臨床需求。 鼻咽癌作為一種具有顯著地域特徵的惡性腫瘤,全球近一半的新發病例集中在中國,且復發或轉移性鼻咽癌(R/M-NPC)患者的整體預後仍不理想。 儘管免疫治療推動了該領域的進步,但一線免疫聯合化療標準方案治療失敗後,二線治療單藥化療方案療效有限,臨床亟需更具突破性的方案。
正是在這一背景下,樂普生物以EGFR ADC(MRG003)聯合PD-1單抗(普特利單抗)的創新策略切入,探索R/M-NPC二線治療的新路徑。 此前,這一組合在早期研究中已顯示出不俗的潜力,而這次在ESMO大會上公佈的II期研究長期隨訪結果,則進一步驗證了這一方案的持續臨床獲益。
在中比特隨訪時間為13.1個月時,MRG003聯合普特利單抗在既往接受免疫及鉑類治療失敗的R/M-NPC患者中,展示出現時同類研究中最高的確認客觀緩解率(ORR)和最長的無進展生存期(PFS)。 具體資料顯示,ORR和DCR分別達到73.3%和93.3%,中比特PFS為10.9個月。 中比特緩解持續時間(DoR)為12.1個月,其中,12例患者仍處於持續緩解狀態。
此次更新中,樂普生物還首次公佈了總生存期(OS)相關資料。 結果顯示,中比特OS尚未成熟,12個月和18個月的OS率分別達到92.8%和85.7%,初步提示該聯合治療方案具有長期生存獲益的趨勢。
值得注意的是,該研究人群中96.7%的患者(29/30)既往接受過PD-(L)1治療,且30%(9/30)接受過EGFR單抗治療。 在這類耐藥人群中仍實現如此療效,也顯示出MRG003聯合普特利單抗在突破免疫耐藥和EGFR通路耐藥方面的潜能。
這一現象或許與其作用機制密切相關。 MRG003通過精准遞送細胞毒藥物,實現對腫瘤細胞的直接殺傷; 而普特利單抗則通過解除免疫抑制、重啓T細胞活性,增强機體的免疫應答。 兩者分別作用於腫瘤治療的不同通路,實現了“內外夾擊”的雙重作用,還可能形成“1+1>2”的協同效應,從而帶來更深度、更持久的抗腫瘤反應。
現時,該組合方案正從“機制驗證”邁向“長期療效確證”階段,相關III期注册研究也在加速推進之中。 從現有數據來看,MRG003聯合普特利單抗方案已經在R/M-NPC二線治療領域取得了前所未有的突破。 若後續研究進一步驗證其療效與安全性,該組合有望重塑R/M-NPC的治療格局,為耐藥患者帶來新的生存希望,也為ADC與免疫聯合策略在更多實體瘤中的臨床拓展提供堅實的實踐依據。
從鼻咽癌到頭頸癌:EGFR ADC+PD-1組合臨床潜力再進階
如果說MRG003聯合普特利單抗方案已在鼻咽癌中經驗證了“可行性”,那麼其在頭頸鱗癌(SCCHN)中的探索,則是更具戰畧意義的“拓展”,同時也彰顯出該組合在跨癌種和多維度應用的臨床潜力。
現時,復發或轉移性SCCHN的一線標準治療以PD-1單藥或PD-1聯合化療為主。 儘管免疫治療顯著延長了患者生存,但總體療效仍有局限,這也暴露了臨床對更高效治療手段的迫切需求。 EGFR是SCCHN的重要靶點,而MRG003聯合普特利單抗方案正借助ADC科技和免疫治療的雙重加持,試圖為復發或轉移性SCCHN一線治療開闢新的方向。
此次ESMO大會更新的II期研究結果,為這種創新療法的進一步應用提供了充分支撐。 該研究納入了37例復發或轉移性SCCHN患者並分劑量探索MRG003與普特利單抗聯合療法的有效性和安全性。 其中,高劑量治療組(DL2)的ORR和DCR分別高達60%和100%,且所有獲得緩解的患者在數據截止時仍處於持續緩解狀態,12個月的DoR率保持100%,療效優勢顯著。 此外,其安全性表現良好,現時仍在隨訪以明確最佳治療劑量。
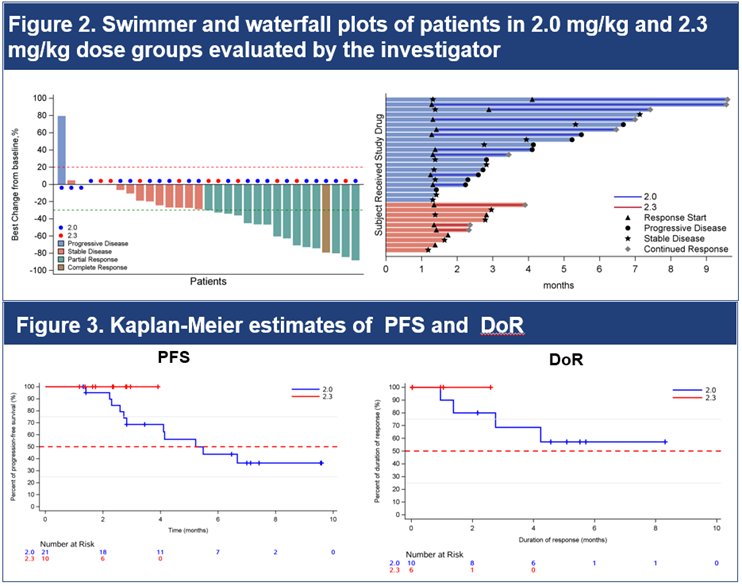
這一結果的意義不止在於“高響應率”,更在於其驗證了ADC+IO策略在複雜腫瘤免疫環境中的廣泛適用性。 SCCHN具有高度異質性,部分患者對免疫檢查點抑制劑反應有限,對EGFR靶向治療的應答也因多樣的基因突變譜存在差异[1]。 在此背景下,MRG003聯合普特利單抗方案仍取得了較高的ORR,若後續在III期臨床研究中延續療效方面的優勢,或可通過雙重作用機制最大化兩類療法的價值,並突破現有的治療瓶頸。
從鼻咽癌到頭頸鱗癌,MRG003與普特利單抗組合的療效優勢正逐步凸顯。 此前,MRG003也開展過單藥研究,而與免疫治療聯合後,無論是在不同腫瘤類型,還是在治療線數前移的治療場景中,均展現出更優的療效表現,可見樂普生物這步“ADC+IO”的棋確實走對了。
其實放眼整個行業,ADC+IO聯合策略雖已是熱門方向,但多數企業還處於佈局階段,真正取得明確療效數據的方案並不多見。 而MRG003與普特利單抗組合療法就是其中之一,這恰恰印證了樂普生物的前瞻視野。 另一方面,也可以看到樂普生物的研發佈局正在有序落地,從單藥到聯合、從後線到前線、從單一瘤種到多適應症開發,樂普生物正以系統性創新逐步構建起以ADC為覈心、免疫協同為驅動的競爭壁壘,穩步夯實其在腫瘤創新賽道的核心競爭力。
聚焦TF新靶點:MRG004A在胰腺癌的新突破
在樂普生物的ADC戰畧版圖中,EGFR只是其深耕多年的覈心靶點之一,而更廣闊的靶點佈局也正全面鋪開。 其中,高潜力的組織因數(TF)無疑是繼EGFR之後的又一關鍵落子。 TF在多種實體瘤中高表達,尤其在胰腺癌中,表達率超過80%,並與更强的侵襲性和不良預後密切相關。 國際上,Seagen(已被輝瑞收購)雖然率先佈局TF ADC,但主要聚焦於宮頸癌等領域,靶點潜能遠尚未被完全挖掘。
樂普生物自主研發的MRG004A,是國內領先的TF ADC之一。 其設計融合了Glyco Connect ™ 定點偶聯和Hydra Space ™ 極性間隔科技,通過將TF靶向單抗與高效抗微管藥物MMAE精確結合,不僅顯著提升了血液中藥物的穩定性,也在殺傷效應與安全性之間實現了理想平衡。 這種結構創新,使MRG004A具備了“高選擇性+高效能”特質,為解决胰腺癌治療困局提供了新的可能。
在此次ESMO大會上披露的I期胰腺癌隊列最新結果中,MRG004A再次交出令人振奮的成績單。 研究共納入39例既往標準治療失敗或不耐受的晚期胰腺癌患者,中比特隨訪時間達15.5個月,生存數據成熟。 在既往接受過至少一線治療的患者中(n=10),客觀緩解率(ORR)達40.0%,疾病控制率(DCR)為80.0%,中比特無進展生存期(PFS)為5.8個月,中比特總生存期(OS)為13.2個月,且安全性可管理。 晚期胰腺癌惡性程度高、進展迅速、且一二線治療仍以化療為主,缺乏能有效的治療手段,MRG004A所展現出的可觀療效,正為患者帶來新的治療可能與希望。
更重要的是,MRG004A的臨床獲益並不依賴特定的生物標誌物。 不同於CLDN18.2、KRAS等靶向藥物受限於分子分型或突變狀態,TF在胰腺癌中具有廣譜表達特徵,使MRG004A天然具備更廣的潜在適用人群。 研究結果顯示,在多線治療後,MRG004A依然展現出穩定的抗腫瘤活性,這為TF靶點在胰腺癌中的臨床可行性提供了堅實證據。
MRG004A於2025年8月正式啟動了III期注册臨床,意味著國產TF ADC進入“加速驗證期”。 這一進展也是樂普生物ADC管線佈局的重要里程碑。 在全球ADC競爭格局中,樂普生物正以穩健的創新節奏,構建覆蓋多靶點、多癌種的管線矩陣,持續拓寬ADC科技在臨床中的應用邊界。
隨著後續III期研究的深入推進,MRG004A有望讓TF這一新興靶點在胰腺癌領域真正“從概念走向現實”。 未來,它或將成為推動胰腺癌治療格局重塑的重要力量,也為ADC科技在難治實體瘤中的深度突破提供了新的可能。
總結
從此次ESMO公佈的三項研究成果中,可以清晰看到樂普生物在ADC領域的研發邏輯與進化路徑:從單藥探索到聯合策略,MRG003與普特利單抗構建起PD-1+ADC的協同體系; 從單一癌種到多適應症拓展,鼻咽癌、頭頸鱗癌等均取得顯著療效,MRG003更已率先進入上市申報階段; 從單靶點到多靶點,研發版圖正由EGFR拓展至TF,並延伸至HER2、CD20、CLDN18.2、GPC3、CDH17等高價值靶點,佈局深度與廣度同步擴展。
如今,全球ADC領域的競爭已處於白熱化階段。 樂普生物憑藉其清晰且前瞻性的研發佈局,精准錨定覈心賽道,不斷用切實的研發成果書寫著自身的成長故事,也讓我們看到了中國藥企在全球醫藥舞臺上綻放光彩的更多可能。
参考资料: [1]Elmusrati, A., Wang, J. & Wang, CY. Tumor microenvironment and immune evasion in head and neck squamous cell carcinoma. Int J Oral Sci 13, 24 (2021). https://doi.org/10.1038/s41368-021-00131-7