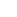6月7日,樂普生物全資子公司上海美雅珂提交的靶向組織因子(tissue factor,TF)的抗體偶聯藥物MRG004A的新藥臨床試驗申請(IND)獲得CDE承辦受理。MRG004A是全球為數不多的進入臨床開發階段的TF ADC藥物,其在美國的IND申請於今年2月已經獲得FDA的準予,正在開展針對TF陽性晚期或轉移性實體瘤的I期研究,如今也是國內第一個申報臨床的TF ADC藥物。

組織因子是一個參與凝血的跨膜蛋白,但是在多種腫瘤中發現TF的异常高表達。TF的异常表達通常與腫瘤生長、血管生成、腫瘤轉移和臨床治療預後差相關,囙此被認為是一個有吸引力的癌症治療靶點,有望滿足多種實體瘤的未滿足臨床需求。
一系列論文報導的免疫組織化學染色結果顯示,TF在多種實體瘤中存在陽性表達,比如宮頸癌陽性率100%,非小細胞肺癌為34%~88%,子宮內膜癌為14%~100%,前列腺癌47%~75%,卵巢癌75%~100%,食管癌43%~91 %,膀胱癌78%[1]。
全球範圍內針對TF這一靶點的在研新藥項目比較稀少,在研的TF ADC藥物也僅有3款,中國現時公開披露的也只有樂普生物/美雅珂一家開發靶向TF的ADC藥物。全球現時尚無任何靶向TF的藥物獲批上市,開發進度最快的是Genmab/ Seagen聯合開發的tisotumab vedotin,同樣也是一款抗體偶聯藥物。
全球在研TF ADC藥物
來源:NextPharma資料庫
與tisotumab vedotin採用的通過鏈間硫醇基團的傳統偶聯科技不同,MRG004A是樂普生物/美雅珂基於從Synaffix引進的GlycoConnectTM定點偶聯科技和HydraSpaceTM極性間隔技術開發的一款創新ADC藥物。
該項技术對偶聯部位具有精准控制,可以降低藥物在血液循環中脫落風險和毒性,具有更寬的治療窗口。
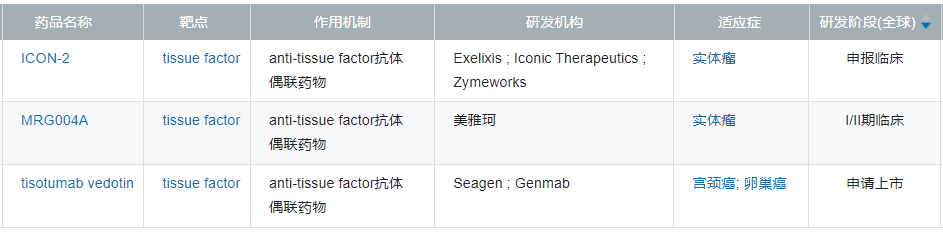
在臨床前研究中,MRG004A已經在攜帶Kras G12V突變的胰腺癌及卵巢癌等多個動物模型中表現出顯著的抗腫瘤活性,顯示出了較好的臨床應用潜力。
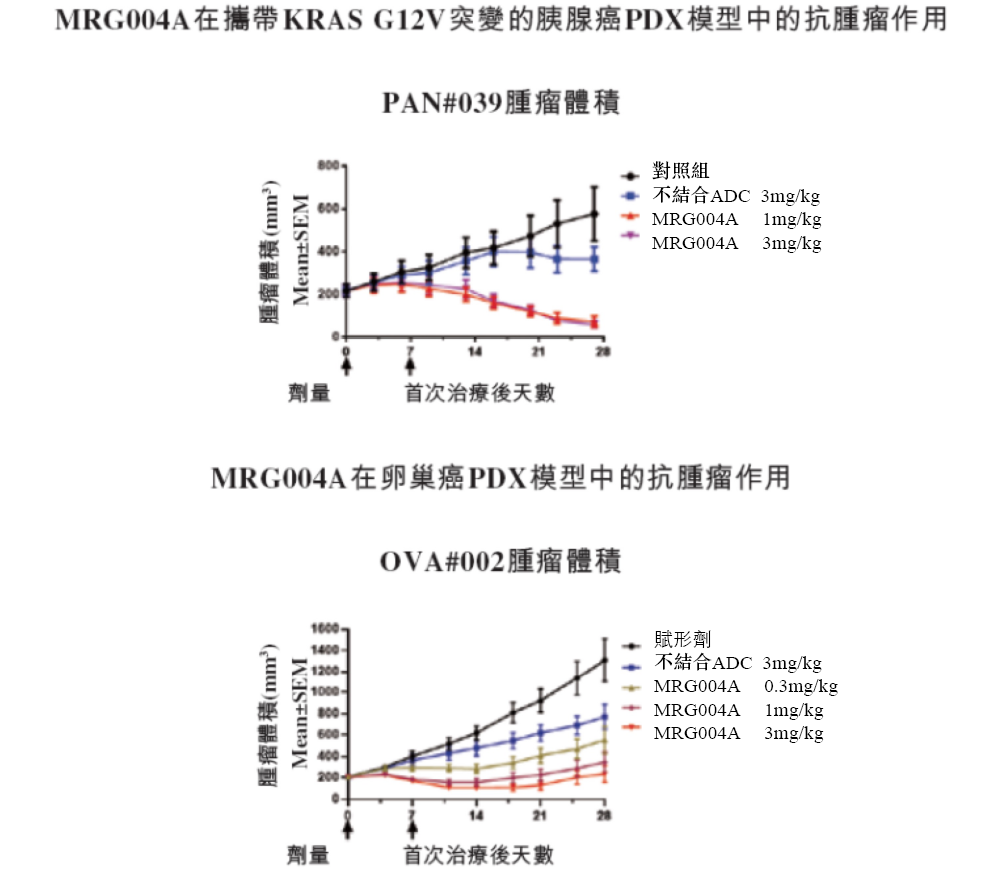
來源:樂普生物招股書
進度最快的TF ADC藥物Tisotumab vedotin的首個適應症是宮頸癌,其在美國的上市申請於今年4月獲得FDA受理,適用於化療期間或化療後復發或轉移的宮頸癌患者。該申請已經獲得了FDA授予的優先審評資格,將在2021/10/10迎來FDA的審批决定。ESMO2020大會公佈的一項關鍵II期innovaTV 204研究結果顯示,tisotumab vedotin作為單藥可為轉移性或復發宮頸癌患者提供具有臨床意義和持久的客觀緩解,ORR為24%,中位緩解持續時間(DOR)為8.3個月。
鑒於MRG004A在臨床前研究中顯示出的良好安全性數據和治療潜力,也期待中國公司研發的TF ADC藥物能够在後續臨床開發中取得出色的數據。
參考資料
[1]Johann S de Bono , Nicole Concin , David S Hong,et al. Tisotumab vedotin in patients with advanced or metastatic solid tumours (InnovaTV 201): a first-in-human, multicentre, phase 1-2 trial. Lancet Oncol. 2019 Mar;20(3):383-393.
文章來源:醫藥魔方