▎Armstrong
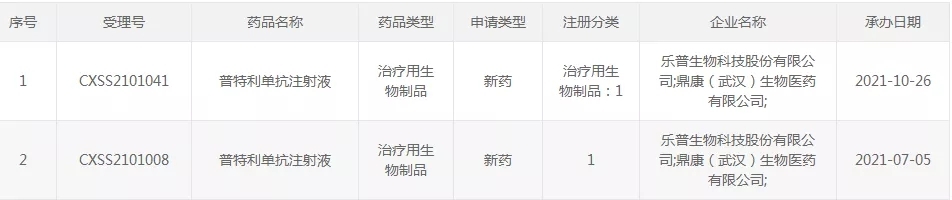
2021年10月26日,樂普生物PD-1單抗普特利單抗(HX008)用於治療MSI-H/dMMR實體瘤的上市申請獲得NMPA受理,這是該產品申報的第二個適應症。此前,二線治療黑色素瘤的上市申請已於2021年7月5日獲得CDE正式承辦受理。
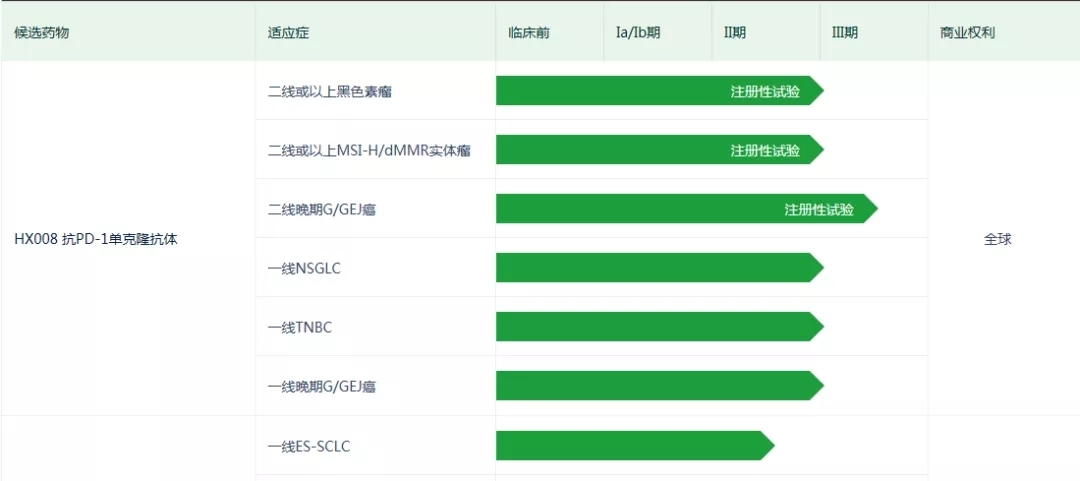
普特利單抗是一款人源化抗PD-1單克隆抗體,其本身優勢在於採用了延長半衰期的設計策略,創新性採用抗體工程技術在IgG4的Fc引入S254T/V308P/N434A突變,以圖減少給藥次數,降低治療費用,進一步提高患者的藥物依從性。 I期臨床結果顯示,該產品的單次給藥半衰期為17.15-23.51天,穩定後半衰期可以達到18.41-38.16天。
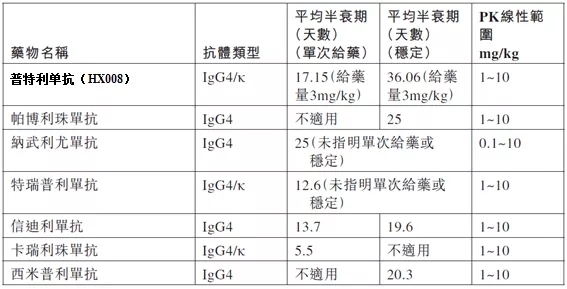
從樂普生物本次獲得NDA受理的MSI-H實體瘤適應症來看,本次遞交主要依據一項在單藥治療高度微衛星不穩定型(MSI-H)或錯配修復缺陷型(dMMR) 晚期實體瘤中開展的關鍵性II期臨床研究結果,患者每三周靜脈注射一次普特利單抗200mg,直至疾病進展、出現不耐受的毒性或停藥。該項目由中國醫學科學院腫瘤醫院的黃鏡教授牽頭,27家參研單位,共入組100例受試者。結果顯示普特利單抗在此適應症中具有良好的療效和安全性。截止到2021年6月3日,該臨床總響應率ORR為46.0%,疾病控制率DCR為70.0%,中位無進展生存期mPFS尚未達到,12個月無進展生存比例為55.1%。中位OS尚未達到,6個月、9個月、12個月的OS率分別為86.0%、79.4%和76.6%。雖然缺少頭對頭的對比,但在現有文獻證據下,如下表所示,普特利單抗單藥治療MSI-H實體瘤療效較為突出。
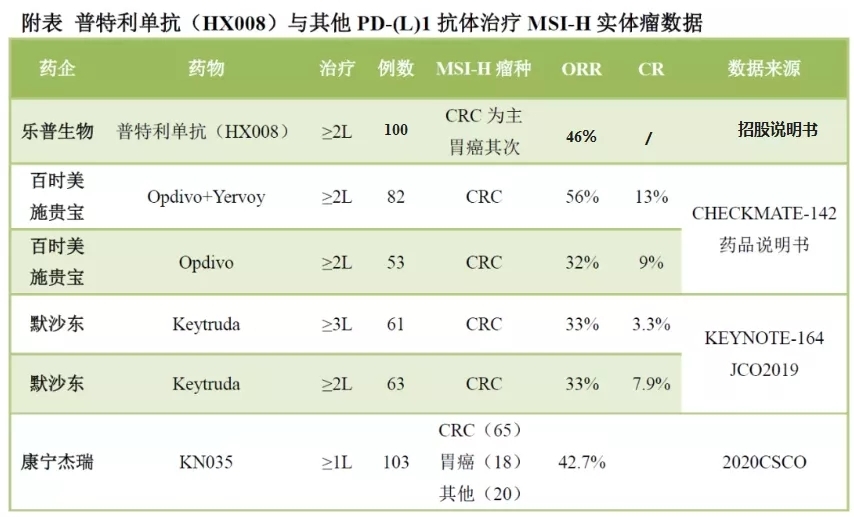
MSI-H/dMMR
目前,抗PD-1/L1療法對於不區分人群的實體瘤整體療效較低,基於腫瘤生物標誌物富集有效率更高的人群是抗PD-1/L1療法的一個發展方向。主要的抗PD-1/L1療法腫瘤生物標誌物包括PD-L1表達水平、MSI-H/dMMR、腫瘤突變負荷(TMB)等。 2016年Ronald J Haus等人利用全基因組外顯子測序方法,分析發現MSI-H在18種癌症均有出現,在所有癌種中的發生率約為14%,其中子宮內膜癌的發生率接近30%,結腸腺癌、胃癌的發生率均為19%左右。
據統計,國內一些常見癌種中每年新發MSI-H的實體瘤患者數量約為31.2萬人,與每年新髮乳腺癌病例數相當,以患者總數及藥物治療MSI-H腫瘤患者比例等計算,預計2030年,MSI-H/dMMR實體瘤潛在用藥人數預計可以達到18.7萬人。目前,國內外僅獲批了3款抗PD-1單抗用於治療MSI-H/dMMR腫瘤,國產PD-1/PD-L1尚未在該適應症獲批。因此,該適應症的市場開發潛力還是值得期待的。
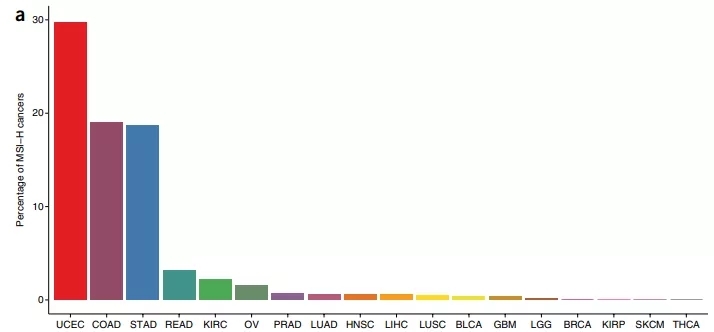
MSI-H/dMMR在18个癌种分布比例
總結
樂普生物科技股份有限公司是一家立足中國、面向全球的聚焦於腫瘤治療領域的創新型生物製藥企業。近年來,樂普生物致力於不斷通過自主創新和戰略合作構建市場差異化的管線,建立並加強自主的生產能力,並通過建設專業的銷售和市場隊伍實現產品管線的國內商業化,通過與境外企業合作將管線推向國際市場,造福更多腫瘤患者。
面對日趨激烈的PD-1市場,普特利單抗不斷覆蓋更多適應症,尤其是胃癌、肺癌、乳腺癌、肝癌等關鍵大瘤種,其中二線治療胃癌已開展註冊性III期臨床研究。
另外,樂普生物還致力於開發具有高度差異化競爭優勢的創新型ADC管線及溶瘤病毒產品,積極探索聯合療法,為患者提供更優的治療方案。普特利單抗接連兩個適應症的NDA申請獲受理也為樂普生物佈局的PD-1聯合治療奠定基礎,根據ASCO和CSCO上免疫聯合化療/靶向或免疫聯合ADC前期臨床數據的公佈,使得免疫聯合ADC產品的機制逐漸被驗證,樂普生物將通過普特利單抗聯合ADC藥物為腫瘤患者後續的聯合治療提供新的方向。