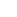MRG002由糖型優化的曲妥珠單抗通過可酶切vc連接子與MMAE偶聯而成,曲妥珠單抗可與腫瘤細胞表面HER2抗原特異性結合,內化並釋放細胞毒有效載荷MMAE,有效抑制微管蛋白聚合,從而乾擾有絲分裂等微管相關功能,發揮殺傷腫瘤細胞的作用。
FIH(First-in-human)Phase I dose escalation and expansion study of anti-HER2 ADC MRG002 in patients with HER2 positive solid tumors
由同濟大學附屬東方醫院李進教授牽頭的這項多中心、開放標籤、劑量遞增和擴展的I期臨床研究旨在評估MRG002治療HER2陽性晚期/轉移性實體瘤患者的安全性、耐受性、藥代動力學特徵和初步抗腫瘤活性。 Ia部分設計為“3+3”劑量爬坡試驗,起始劑量為0.3 mg/kg,隨後遞增為0.6、1.2、1.8、2.2、2.6和3.0 mg/kg;Ib擴展試驗探索每3週一次、2.6 mg/kg劑量下MRG002治療多線經治、晚期/轉移性乳腺癌、胃癌等HER2陽性實體瘤患者的安全性、劑量限制性毒性(DLT)和抗腫瘤活性,每2個週期進行一次療效評估。
Ia階段共納入25例HER2陽性晚期/轉移性實體瘤患者(19例乳腺癌、3例唾液腺癌、2例胃癌、1例結直腸癌),確定了MRG002治療的最大耐受劑量(MTD)和RP2D。患者的中位年齡為53(30-66)歲,中位治療線數為5(1-11),接受每3週一次、最多8個週期的MRG002治療。安全性方面,≥20%常見的TRAE有中性粒細胞計數減少,AST升高,白細胞計數減少,乳酸脫氫酶升高,脫髮,CPK升高,ALT升高,甘油三酯升高,膽固醇升高,GGT升高,食慾下降和感覺減退。不良事件多為輕至中度。最常見的≥3級TRAE為中性粒細胞計數減少和甘油三酯升高各3例(12%)。 6例患者(24%)發生了治療相關嚴重不良事件(SAE),包括GGT升高,AST/ALT升高,中性粒細胞計數減少,LEVF減少,疲勞和周圍神經病變。
療效方面,在至少進行過一次腫瘤評估的21例患者中,9例評估為PR(43%),8例為SD(38%),4例為疾病進展(PD,19%)。其中,16例HER2陽性乳腺癌患者的療效評估為8例PR,5例SD,ORR為50%(8/16),DCR為81%(13/16)。 3.0 mg/kg治療劑量下發生了2例DLT,包括LVEF降低和CPK升高。因此,最終確認的RP2D為2.6 mg/kg,目前評估該劑量下MRG002療效和安全性的Ib擴展試驗正在積極開展中。
結論:MRG002的劑量遞增試驗顯示了其在HER2陽性實體瘤(乳腺癌、胃癌等)患者中可控的安全性和令人鼓舞的抗腫瘤活性,II期臨床研究將繼續前行探索。
喜訊連連,在9月25~29日即將召開的第24屆全國臨床腫瘤學大會暨2021年中國臨床腫瘤學會(CSCO)學術年會上,李進教授將在大會主旨報告專場詳述該研究進展,而解放軍總醫院腫瘤醫學部江澤飛教授將在創新專場帶來新型抗體偶聯物(MRG002-ADC)治療HER2低表達晚期乳腺癌的多中心II期研究的主題報告。我們拭目以待!